לאטומים יש רצונות כמו שלבני אדם יש? (7)
-sulfate-3D-vdW.png) |
שלום לכל החנונים המגניבים,
בפוסט הקודם דיברנו על קשר קוולנטי, היום נדבר על קשר נוסף הקורה בין אטומים-קשר יוני.
לפני שנבין מה זה קשר יוני, בואו נבין מהם יונים?
*יון: אטום בעל מטען חשמלי (1).
כל פרוטון נותן מטען חיובי 1 (+)
וכל אלקטרון נותן מטען שלילי 1 (-).
כאשר יש מספר = של פרוטונים ואלקטרונים מטען האטום = לאפס (ניטרלי).
מספר עודף של אלקטרונים ייתן מטען שלילי (-) וחוסר באלקטרונים ייתן מטען חיובי (+).
וזה למעשה יון, אטום טעון במטען חשמלי חיובי/שלילי.
יון חיובי נקרא-קטיון
ויון שלילי נקראה-אניון.
אבל איך אטומים מגיעים למצב שהמטען שלהם לא ניטרלי?
*אטומים מעדיפים מערכת ערכיות מלאה.
לכן, אטומים שמערכת הערכיות שלהם ריקה, יוותרו על אלקטרוני הערכיות ויהפכו לקטיונים.
אטומים שמעטפת הערכיות שלהם מלאה, ימשכו בדרך כלל אלקטרון ויהפכו לאניונים.
 |
https://commons.wikimedia.org/wiki/File:IonicBondingRH11.png |
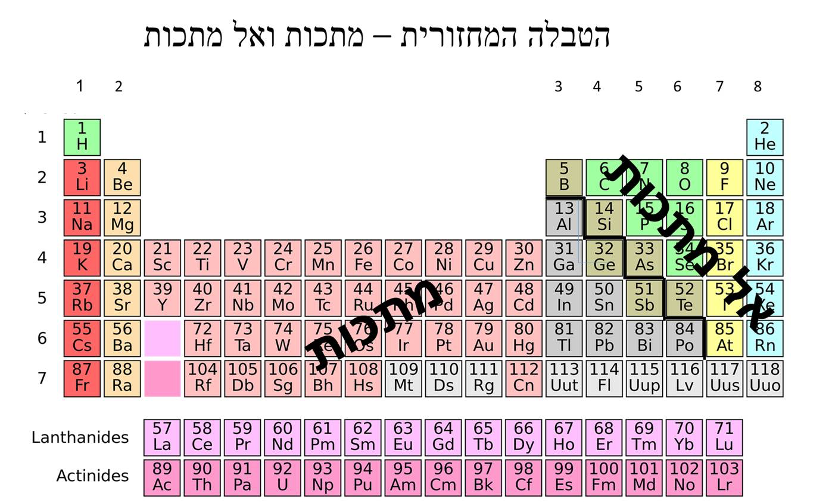
בצד ימין של הטבלה המחזורית מופיעים אלקטרונים בעלי מטען שלילי בדרך כלל.
ובצד שמאל מופיעים אלקטרונים בעלי מטען חיובי.
(2).
 |
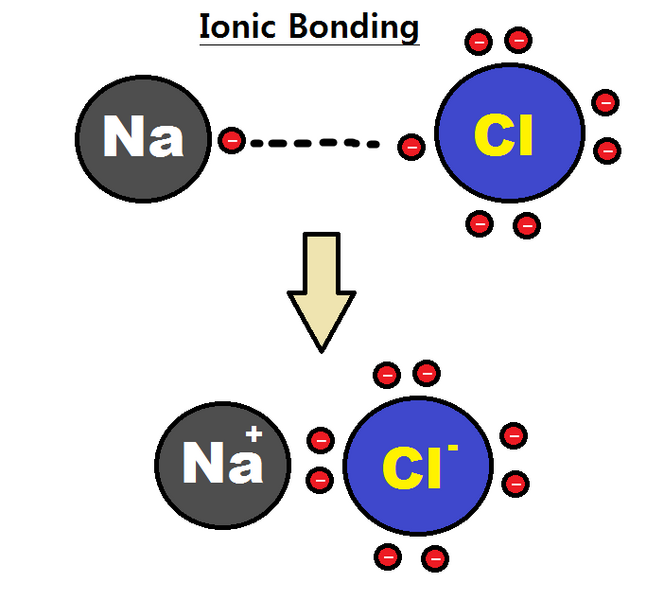
עכשיו, מהו קשר יוני?
*קשר יוני: מעבר של אלקטרונים מאטום 1 (בד"כ מתכת) לאטום אחר (בד"כ אל-מתכת).
מה זאת אומרת? עכשיו מסבירה.
בקשר יוני, אטום 1 לוקח אלקטרון מאטום אחר.
התוצאה: נוצר יון חיובי (קטיון) ויון שלילי (אניון) הנמשכים זה לזה בכוחות אלקטרוסטטיים.
*כוח אלקטרוסטטי: כוח המושך/דוחה בין חלקיקים בשל מטענם החשמלי (3).
(4).
 |
זו כל התורה מסיני. כדי שתבינו יותר טוב אסביר לכם את זה בדוגמה: נתרן כלורי או בשפת המדענים-מלח שולחן (NaCℓ) הוא תוצר של קשר יוני. הוא מורכב מקטיונים של נתרן (Na+) היוצרים קשרים יוניים עם אניונים של כלור (Cℓ-).
לאטום Na יש אלקטרון 1 ברמת הערכיות, לכן, הוא נוטה למסור אלקטרון וכתוצאה מכך הוא הופך לקטיון.
לאטום Cℓ יש 7 אלקטרונים ברמת הערכיות, לכן, הוא נוטה לקלוט אלקטרון 1 והופך לאניון.
לבסוף, נוצרת ביניהם תרכובת יונית.
(5).
 |
תמשיכו להיות חנונים מגניבים, נתראה.
מקורות מידע:
בריינפופ ישראל-יונים, 00:20-00:25
בריינפופ ישראל-יונים, 01:33-02:12
הגדרות כימיה: מהם כוחות אלקטרוסטטיים?, תחת הכותרת: "הגדרת כוחות אלקטרוסטטיים"
מצגת-כימיה כללית ופיסיקלית לתלמידי רפואה-קשרים כימים וגיאומטריה מולקולרית, שקופית 5
מצגת-יונים וחומרים יונים-בלה וכסלר, שקופיות 5, 6, 7, 8


תגובות
הוסף רשומת תגובה